 |
|
 |
| |
 |
Calor absorvido e liberado nas reações
|
 |
|
|
 |
|
 |
| |
|
Reações químicas e mudanças de estado físico podem liberar ou absorver energia na forma de calor.
|
|
|
 |
|
 |
| |
As unidades utilizadas para medir calor são:
caloria (cal)
quilocaloria (kcal ou Cal)
joule (J) (1 caloria = 4,18 joules
quilojoule (kJ) |
 |
|
|
|
| |
Calor é a energia transferida como resultado de uma diferença de temperatura |
|
|
|
|
|
|
|
 |
|
 |
| |
|
Além de calor, a energia pode ser absorvida ou liberada por um sistema na forma de luz ou energia elétrica. Por exemplo, quando uma fita de magnésio é queimada, há liberação de energia tanto na forma de calor quanto de luz.
|
 |
|
|
|
| |

|
|
| |
 |
|
| |
Magnésio
|
|
|
|
|
|
|
|
 |
|
 |
| |
Reações exotérmicas e endotérmicas
Uma reação é exotérmica se as ligações que se formam nos produtos liberam mais energia que a necessária para quebrar as ligações nos reagentes. Por outro lado, se for necessário mais energia para quebrar ligações do que a energia liberada na formação de novas ligações, estamos frente a um processo endotérmico. Energia química é, portanto, a energia associada às ligações químicas.
|
|
|
 |
|
 |
| |
|
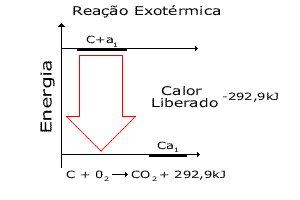
Os processos que liberam calor são chamados exotérmicos. A queima de combustíveis é um exemplo de processo exotérmico. Nas reações exotérmicas o calor pode ser visto como um produto.
|
 |
|
|
|
| |
|
|
| |
 |
|
| |
Exotérmica
|
|
|
|
|
|
|
|
 |
|
 |
| |
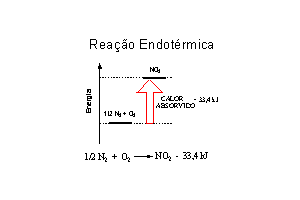
Outras reações, como a combinação de N2 e O2 para formar NO, são processos endotérmicos. Em tais reações há absorção de energia na forma de calor.
|
 |
|
|
|
| |
|
|
| |
 |
|
| |
Endotérmica
|
|
|
|
|
|
|
|
 |
|
 |
| |
| Nos diagramas de energia, fica fácil observar que há liberação (reação exotérmica) ou absorção (reação endotérmica) de energia na forma de calor. Em termoquímica, o calor liberado ou absorvido em uma reação conduzida a pressão constante, é chamado entalpia. |
 |
|
|
|
| |
No século XIX, o cientista Germain Hess realizou importantes pesquisas relacionadas ao calor liberado ou absorvido pelas reações químicas. A partir destes estudos, desenvolveu-se um método eficiente conhecido como Lei de Hess, que permite o cálculo da energia envolvida em uma reação, seja ela endotérmica ou exotérmica. |
|
|
|
|
|
|
|
 |
|
 |