 |
|
 |
| |
 |
Solubilidade nas Soluções
|
 |
|
|
 |
|
 |
| |
|
A solubilidade é uma propriedade que serve para descrever quantitativamente a composição de uma solução. Em geral, existe um limite de solubilidade, onde não se consegue dissolver mais soluto no solvente. Esse limite é estabelecido pelo coeficiente de solubilidade e depende da natureza do soluto e do solvente, da temperatura e da pressão.
|
|
|
 |
|
 |
| |
|
|
|
| |
|
|
| |
 |
|
| |
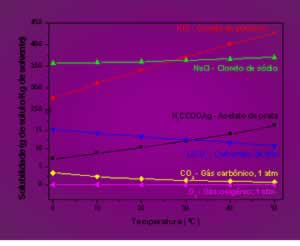
Gráfico de solubilidade para diversas substâncias
|
|
|
|
|
|
|
 |
|
 |
| |
- Natureza do Solvente e do Soluto: Uma regra importante para descrever a solubilidade é que “semelhante dissolve semelhante”. Assim, é de se esperar uma solubilidade mais alta quando as moléculas do soluto são semelhantes na estrutura e propriedades elétricas do solvente. Por esta razão, a água, que é uma substância polar, é um bom solvente para o álcool, que também é uma substância polar, porém, um solvente ruim para a gasolina, que é um composto não polar.
- Temperatura: A variação da solubilidade com a temperatura está intimamente relacionada com o calor de dissolução da substância. De maneira geral, não há uma regra global para a variação da solubilidade de sólidos, líquidos e gases. Usualmente, a solubilidade de gases diminui e dos sólidos e líquidos aumenta com o aumento da temperatura da solução. Porém, isto não é verdadeiro para todas as situações. Como exemplo temos gases que não são solúveis em outros solventes líquidos, além disto, a solubilidade de substâncias como o carbonato de lítio em água diminui com o aumento de temperatura.
- Pressão: A solubilidade de líquidos e sólidos não é praticamente afetada por esta propriedade. Contudo, a solubilidade dos gases aumenta com o aumento da pressão parcial do gás. Para dissolução de gases em líquidos, a solubilidade é governada pela Lei de Henry:
A concentração de um gás, em um líquido, a uma dada temperatura constante, é diretamente proporcional à pressão parcial do gás na solução.
Cgás = kgás x Pgás portanto C1/P1 = C2/P2
onde Kgás é uma constante específica para cada gás.
|
|
|
 |
|
 |
| |
|
|
|
|
Constantes de alguns gases para a Lei de Henry.
|
|
|
|
|
|
| Gases |
Kgás/Torr |
| Dióxido de carbono, CO2 |
1,25 x 106 |
| Oxigênio, O2 |
3,30 x 107 |
| Hidrogênio, H2 |
5,340 x 107 |
| Nitrogênio, N2 |
6,51 x 107 |
|
|
|
|
|
|
|
 |
|
 |
| |
Um bom exemplo de solubilidade de gases em líquidos, que faz parte do dia a dia das pessoas, são os refrigerantes. Os refrigerantes de um modo geral são soluções de gás carbônico em água. O gás carbônico é inserido na garrafa sob elevada pressão, assim, sua solubilidade com a garrafa fechada é alta, pois depende da pressão parcial de CO2 na fase gasosa. Quando a garrafa é aberta, a pressão de gás carbônico diminui e, conseqüentemente a sua solubilidade, formando por isto bolhas que escapam da bebida.
Com base na solubilidade, as soluções podem ser classificadas em três tipos:- Não-saturadas: A quantidade de soluto não atinge o coeficiente de solubilidade e mais soluto pode ser dissolvido a uma dada temperatura e pressão;
- Saturadas: A quantidade de soluto atinge o coeficiente de solubilidade e, se mais soluto for adicionado, este se precipita da solução, formando um corpo de fundo;
- Super-saturadas: A quantidade de soluto supera o coeficiente de solubilidade. Este tipo de solução geralmente é preparada alterando-se a temperatura do meio. Por exemplo, o cloreto de potássio aumenta sua solubilidade com o aumento de temperatura, assim, se tivermos uma solução saturada com excesso de cloreto de potássio, este pode ser dissolvido aquecendo-se a solução. Curiosamente, se a solução é resfriada lentamente pelo ambiente, o excesso de soluto dissolvido não se precipita e a solução é descrita por estar em equilíbrio metaestável. Isto é, se adicionarmos um pequeníssimo cristal de cloreto de potássio ou fizermos uma pequena perturbação mecânica, todo o excesso de soluto cristaliza e a solução retorna ao seu estado original de saturação.
|
|
|
 |
|
 |