| |
Podemos calcular a variação de entalpia (DH) de uma reação conhecendo os valores de energia das ligações existentes entre os átomos das substâncias envolvidas na reação.
Considere o exemplo: N2 (g) + 3 H2 (g)  2 NH3 (g) 2 NH3 (g)
Para formar 2 moléculas de amônia a partir de uma molécula de nitrogênio e três moléculas de hidrogênio, devemos primeiro quebrar as ligações presentes nas moléculas dos reagentes em átomos livres e então formar novas ligações a partir destes átomos:
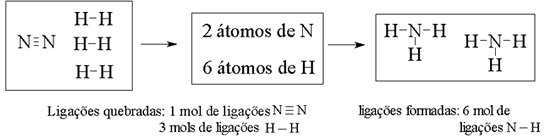
Dispondo de valores para as energias de ligação, podemos calcular o DH para a reação utilizando a expressão:
A variação de entalpia é obtida através do somatório das ligações rompidas menos o somatório das ligações formadas.
Dadas as energias de ligação:
DH (N-N) = 941 kJ/mol
DH (H-H) = 436 kJ/mol
DH (N-H) = 389 kJ/mol
DH= 941 + 3.(436) - 6.(389)
DH = - 85 kJ
|
|
|