| |
Tipos de D H
A variação de entalpia (D H) é definida como calor recebido ou liberado em qualquer processo físico ou químico que ocorra a pressão constante. Assim, podemos quantificar através dela a energia envolvida em processos como mudanças de estado físico ou em reações de formação, combustão, neutralização, etc. Note que em todos os casos estamos frente a uma mesma manifestação de energia, que recebe diferentes nomes dependendo do fenômeno em questão.
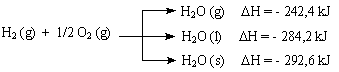
D H e Estado FísicoQuando se altera o estado físico de reagentes ou produtos de uma reação, o valor da variação de entalpia também muda. Por exemplo, na reação de formação da água a partir de H2 e O2, dependo do estado físico do produto (água) teremos diferentes valores de D H.
DH e o Estado AlotrópicoVariando-se o estado alotrópico de um elemento envolvido em uma reação, o valor de DH é alterado.
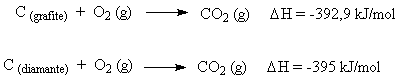
Entalpia de Formação (DHf) ou Calor de Formação
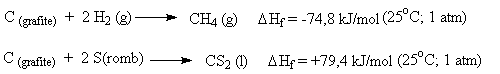
É a quantidade de calor associada ao processo de formação de um mol de uma substância, a partir dos elementos correspondentes no estado padrão. O estado padrão pode ser definido como:
estado físico e alotrópico mais estáveis, na temperatura de 25oC e pressão de 1 atm.
Por definição, a forma alotrópica mais estável de um elemento químico possui entalpia igual a zero nas condições padrão. Formas alotrópicas menos estáveis possuem entalpia maior que zero. O oxigênio, por exemplo, possui duas formas alotrópicas: O2 (oxigênio gasoso) e O3 (ozônio). A entalpia da forma mais estável (O2) é igual a zero.
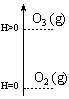
A entalpia de uma substância é numericamente igual ao valor de seu calor de formação.
Entalpia ou Calor de Combustão
É a energia associada ao processo de combustão completa de um mol de uma substância, considerando-se que todos os participantes estão no estado padrão. Reações de combustão são sempre exotérmicas (DH <0), e sempre são conduzidas na presença de oxigênio. Quando a combustão é completa, os produtos são CO2 e água.
A combustão de um mol de metano, por exemplo, libera 889,5 kJ.
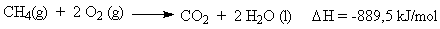
|
|
|