 |
|
 |
| |
 |
Lei da velocidade de reação e mecanismo de reação
|
 |
|
|
 |
|
 |
| |
A uma dada temperatura, a velocidade de uma reação é diretamente proporcional ao produto das concentrações molares dos reagentes, elevadas às potências experimentalmente determinadas. Este é o enunciado da lei de Guldberg-Waage ou lei da velocidade de reação. Em uma reação de equação geral,

a equação de velocidade será:

onde,
v = velocidade de reação em uma dada temperatura T
k = constante de velocidade na temperatura T
[A] = concentração de A em mol.L-1
[B] = concentração de B em mol.L-1
p e q são coeficientes determinados experimentalmente.
|
|
|
 |
|
 |
| |
Desta forma, a lei de velocidade é uma equação que expressa a velocidade da reação em função das concentrações dos reagentes.
Algumas reações químicas ocorrem em uma única etapa e, por este motivo, são chamadas reações elementares. Neste caso, supondo-se a reação, teremos como lei de velocidade:

Note que nas reações elementares, os coeficientes estequiométricos a e b (que indicam o número de moléculas ou íons que participam da reação) são as potências da equação de velocidade.
|
|
|
 |
|
 |
| |
Mecanismo é o conjunto das etapas em que ocorre uma reação. O mecanismo de uma reação é proposto com base no estudo de sua velocidade. É importante saber que ele é uma suposição, uma hipótese, já que dificilmente ele pode ser provado.
A maioria das reações ocorre segundo mecanismos que envolvem várias etapas ou passos. Cada passo de um mecanismo deve ser visto como uma reação elementar. A etapa lenta de um mecanismo é a que determina a velocidade da reação. Assim, os valores de concentração e os coeficientes p e q devem ser dos reagentes presentes na etapa lenta.
Para que isso fique bem claro, considere o seguinte exemplo:

Esta reação ocorre segundo o mecanismo:
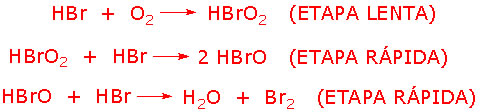
Para determinar a lei de velocidade da reação, devemos observar apenas a sua etapa lenta. Nesta etapa, a molécula de HBr reage com O2 para formar um intermediário HBrO2, ou seja, para que a reação comece, é necessário que uma molécula de HBr colida com uma de O2. Deste modo, a lei de velocidade para a reação global será:

|
|
|
 |
|
 |
| |
|
|
|
|
Para saber mais sobre este assunto acesse os links: |
|
|
|
|
|
|
|
|
|
 |
|
 |