| |
|
|
|
|
Velocidades Médias para a Reação de Hidrólise de Brometo de terc-Butila
|
|
|
|
|
|
| Tempo (s) |
[t-BuBr] (mol.L-1) |
[t-BuOH] (mol.L-1) |
mol.L-1.s-1 |
| 0 |
0,1000 |
0 |
|
| 10 |
0,0876 |
0,0124 |
1,24 x 10-3 |
| 20 |
0,0768 |
0,0232 |
1,08 x 10-3 |
| 30 |
0,0672 |
0,0328 |
0,96 x 10-3 |
| 40 |
0,0590 |
0,0410 |
0,82 x 10-3 |
| 50 |
0,0517 |
0,0483 |
0,73 x 10-3 |
| 60 |
0,0453 |
0,0547 |
0,64 x 10-3 |
| 80 |
0,0348 |
0,0652 |
0,53 x 10-3 |
| 100 |
0,0267 |
0,0733 |
0,41 x 10-3 |
| 120 |
0,0205 |
0,0795 |
0,31 x 10-3 |
| 180 |
0,0093 |
0,0907 |
0,19 x 10-3 |
| 240 |
0,0042 |
0,0958 |
0,09 x 10-3 |
|
|
|
|
|
|
|
| |
Através da mesma tabela, podemos calcular a velocidade média da reação. Escolhemos um dos participantes (reagente ou produto) e um intervalo de tempo qualquer, como por exemplo, os primeiros dez segundos da reação. Escolhendo o reagente, teremos:

Note que a variação na concentração de t-BuBr é negativa. O sinal (-) na equação acima existe apenas para que não tenhamos valores negativos de velocidade
De modo análogo, a velocidade calculada em função do produto é:
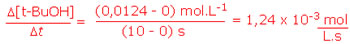
Toda esta metodologia é a base o cálculo da velocidade de qualquer reação. Para tanto, é necessário apenas acompanhar a variação na concentração de um dos participantes da reação, independentemente deste participante ser um reagente ou um produto. Este acompanhamento pode ser feito por medidas experimentais, como medições de pH, titulações ou pela cor da reação (quando o produto formado é colorido).
|
|
|