 |
|
 |
| |
 |
A Lei da Ação das Massas
|
 |
|
|
 |
|
 |
| |
|
A lei para descrever o equilíbrio químico foi proposta em 1864 pelos químicos noruegueses C. M. Guldberg e P. Waage, a qual denominaram de Ação das Massas.
|
|
|
 |
|
 |
| |
|
A lei de Ação das Massas pode ser definida para uma reação genérica, da seguinte forma:
|
 |
|
|
|
 |
|
 |
| |
|
A "força de ação" entre dois reagentes genéricos, A e B, é proporcional às suas "massas ativas", assim como a força de ação entre C e D. No equilíbrio, a força de ação entre A e B é igual a força de ação entre C e D". Apesar dos termos "força de ação" e "massa ativa" não serem muito bem explicados por Guldberg e Waage, seu trabalho foi o precursor no desenvolvimento de uma descrição adequada do equilíbrio químico.
|
|
|
 |
|
 |
| |
|
A Lei do Equilíbrio Químico foi descoberta experimentalmente. Tomando como exemplo a reação:
|
 |
|
|
|
 |
|
 |
| |
|
|
|
|
Concentração (molar)
|
|
|
|
|
|
| Experimento |
CO |
Cl2 |
COCl2 |
| 1 |
1,21 |
0,21 |
0,79 |
| 2 |
1 |
1 |
3,1 |
| 3 |
0,66 |
1,66 |
3,34 |
| 4 |
0,43 |
0,43 |
0,57 |
|
|
|
|
|
|
|
 |
|
 |
| |
Observa-se que a relação entre a concentração dos produtos e dos reagentes é constante. Esta relação pode ser expressa pela equação:
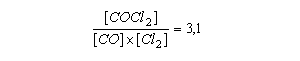
Logo, estendendo esta relação para uma reação genérica, temos a expressão para a ação das massas:
sendo K denominado de constante de equilíbrio.
|
|
|
 |
|
 |