 |
|
 |
| |
 |
Energia de Ativação
|
 |
|
|
 |
|
 |
| |
Qualquer molécula em movimento possui energia cinética. Quanto mais rápido for o movimento das moléculas, maior é a facilidade com que elas se fragmentam ao colidir.
Considere a analogia: quando dois carros andando em baixas velocidades colidem, em geral, pequenos danos são causados. No entanto, uma colisão entre dois carros trafegando em altas velocidades irá provocar estragos muito maiores.
|
|
|
 |
|
 |
| |
|
Em uma reação nem todas as moléculas reagem, porque não colidem entre si com força suficiente, ou seja, a energia de uma colisão deve ser grande o suficiente para que as ligações nas moléculas sejam quebradas ou enfraquecidas, para que novas ligações sejam formadas. A mínima energia que uma colisão deve ter para que a reação ocorra é chamada ENERGIA DE ATIVAÇÃO (Ea). A energia de ativação pode ser imaginada como uma barreira a ser transposta a fim de que as moléculas possam reagir. A situação é parecida no caso de uma pedra que é rolada até o alto de um morro. Gasta-se muita energia para levá-la até o topo. No alto, basta empurrá-la para que continue em frente sozinha.
|
 |
|
|
|
 |
|
 |
| |
|
Quando pensamos em uma reação química, precisamos reconhecer que a intensidade das ligações químicas nos reagentes é diferente daquela observada nos produtos. Quanto mais intensas forem as ligações entre os átomos, mais estável será a molécula.
|
|
|
 |
|
 |
| |
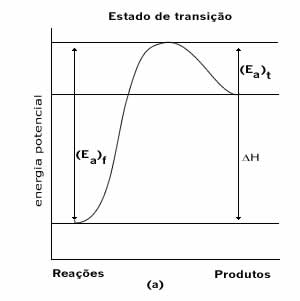
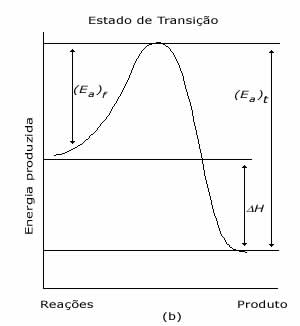
Estas afirmações podem ser ilustradas através de um perfil de reação, que mostra a diferença de energia existente entre reagentes e produtos.
Em uma reação, se os produtos apresentam uma energia menor que dos reagentes, é sinal de que houve liberação de energia e tais reações são chamadas exotérmicas. Por outro lado, se os produtos apresentam energia maior que a dos reagentes estamos frente a uma reação que absorve energia, ou seja, uma reação endotérmica.
|
 |
|
|
|
| |
|
|
| |
 |
|
| |
Reação Endotérmica
|
|
|
|
|
|
|
|
 |
|
 |
| |
O calor liberado ou absorvido em uma reação não é o único fator a ser considerado. Quando duas moléculas reagem, ligações químicas devem ser quebradas e refeitas. De fato, as moléculas não são despedaçadas e as ligações simplesmente se refazem. A teoria mais aceita é a de que as moléculas se agregam para formar espécies químicas conhecidas como intermediários de reação.
A magnitude da energia de ativação determina quanto as moléculas dos reagentes serão transformadas em produtos, bem como que tipo de ligação será quebrada e formada. A introdução de um catalisador no meio reacional provoca uma mudança no mecanismo de reação, de modo que ela ocorra por um caminho que apresente uma energia de ativação mais baixa.
|
 |
|
|
|
| |
|
|
| |
 |
|
| |
Reação Exotérmica
|
|
|
|
|
|
|
|
 |
|
 |